Muchas veces escuchamos el dicho “se dobla pero no se rompe”. La luz tiene la capacidad de “doblar”. Para entender por qué tenemos que hacernos algunas preguntas antes.
Normalmente pensamos que el aire no influye para nada en la forma en la que suceden las cosas. Esto es incorrecto. El aire influye sobre la transmisión de la luz así como cualquier otro material. Cuando decimos que los materiales influyen sobre la transmisión de la luz, debemos tener en cuenta que lo que se modifica es la velocidad de la luz. ¿Cómo puede ser? ¿La velocidad de la luz no es única y constante?
La respuesta es que no. La velocidad de la luz cambia dependiendo del medio en el que la luz se transmite. Normalmente, tendemos a pensar que la velocidad de la luz en el vacío (denotada como “c” ) es la única velocidad de la luz. Sin embargo, la correcta expresión de la velocidad de la luz surge de la siguiente ecuación:
Vp . n = c
Donde Vp es la velocidad de la luz en el medio particular, n es el índice de refracción y c es la velocidad de la luz en el vacío.
Todo muy lindo pero ¿qué es el índice de refracción? El índice de refracción surge de mediciones experimentales. Es el número que surge del cociente entre Vp y c, al medir experimentalmente la velocidad en el medio. Lógicamente, el indice de refracción para el vacío es 1 (Vp=c). Pero los demás materiales, incluyendo al aire, poseen un índice de refracción distinto. Abajo mostramos una tabla con los índices de refracción según el material.
Material
| Índice de refracción |
|---|---|
1
| |
Aire (*)
|
1,0002926
|
1,3330
| |
1,35
| |
Solución de azúcar (30%)
|
1,38
|
1-butanol (a 20 °C)
|
1,399
|
1,473
| |
Heptanol (a 25 °C)
|
1,423
|
Solución de azúcar (80%)
|
1,52
|
Benceno (a 20 °C)
|
1,501
|
Metanol (a 20 °C)
|
1,329
|
1,544
| |
Vidrio (corriente)
|
1,52
|
1,6295
| |
1,544
| |
2,42
| |
(*) en condiciones normales de presión y temperatura (1 bar y 0 °C)
| |
La ley de Snell nos ayuda a calcular qué ocurrirá con los rayos de luz después de que sucede el cambio de medio. Existen dos tipos de rayos: los reflejados y los refractados. Los rayos que se reflejan, lo hacen con el mismo ángulo que el rayo incidente. Los rayos refractados varían dicho ángulo respecto de la normal (ver imagen abajo).
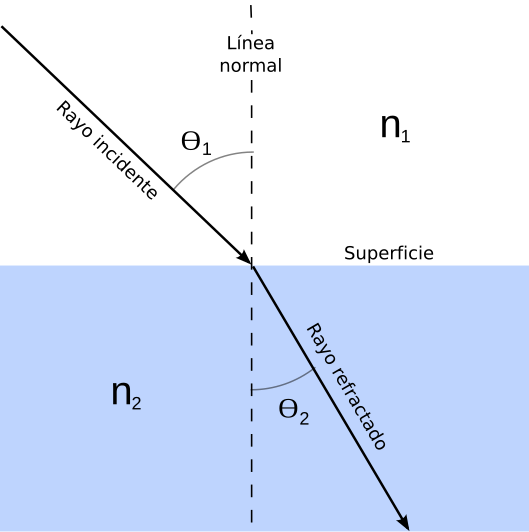
Es por eso que la luz “dobla” o, mejor dicho, cambia su trayectoria respecto de la normal. Para entender un poco más sobre el cálculo y la resolución de ejercicios les dejamos nuestro video sobre la Ley de Snell.