Cuando respiramos, incorporamos oxígeno (O2) del aire y eliminamos dióxido de carbono (CO2). Esto es así debido a que la respiración celular es un proceso en el que el oxígeno y la glucosa dan dióxido de carbono que debe ser eliminado, además del agua que también puede ser reutiliza.
Glucosa + O2
![clip_image001[4] clip_image001[4]](http://lh4.ggpht.com/-gCWTnOfzgys/UkcdHc7La9I/AAAAAAAAAF4/gNuinEt-e9s/clip_image001%25255B4%25255D_thumb.gif?imgmax=800) CO2 + H2O
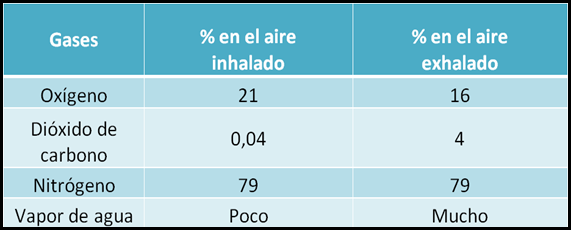
CO2 + H2OEl dióxido de carbono lo eliminamos durante la exhalación del aire que respiramos. Si miramos la composición del aire inhalado y la comparamos con la del aire exhalado podemos ver que la cantidad de oxígeno disminuye un poco mientras que la de dióxido de carbono aumenta considerablemente .
Pero…¿cómo se relaciona con el experimento que hicimos?
La solución que utilizamos tenía disuelto Calcio y le burbujeamos dióxido de carbono. Cuando hacemos esto, ocurren distintos equilibrios químicos que terminan con la precipitación de carbonato de calcio (CaCO3)
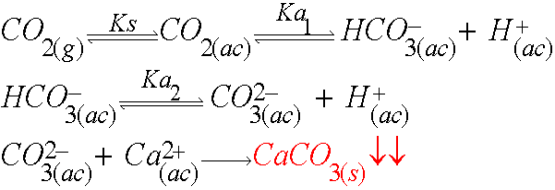
Primero, el dióxido de carbono gaseoso se disuelve en agua. Este equilibrio tiene una constante de solubilidad (Ks) muy elevada por lo que directamente podríamos considerar el primer equilibrio ácido-base del dióxido de carbono que da el ion bicarbonato más un protón. El próximo paso es menos favorable porque el bicarbonato es un ácido bastante débil. Aún así, a medida que más dióxido de carbono es burbujeado al sistema, mayor será la cantidad de bicarbonato por lo que, eventualmente, la concentración de carbonato (CO32- ) irá aumentando. El paso que desplaza todos los equilibrios es la precipitación del carbonato de calcio.
La precipitación de los iones en solución acuosa está dada por la llamada constante del producto de solubilidad o Kps.
En este caso, el Kps del CaCO3 = 3,8 . 10-9
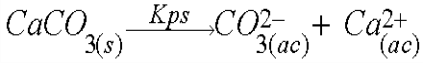
Dado que el número es muy pequeño (exponente –9), la reacción está fuertemente desplazada hacia reactivos y por ende, todo el carbonato que se genere precipitará con el calcio disuelto y por eso vemos el cambio de color del agua hacia un blancuzco turbio. El carbonato de calcio queda en suspensión y poco a poco decanta.